INBUILD® fue el primer y único ensayo de fase 3 que agrupó las EPID fibrosantes crónicas con un fenotipo progresivo en función de similitudes clínicas y biológicas.
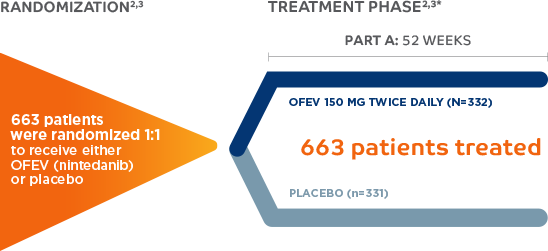
INBUILD® FUE UNA PRUEBA DE FASE 3 ALEATORIZADA, DOBLE CIEGO, CONTROLADA POR PLACEBO DURANTE 52 SEMANAS EN PACIENTES CON ENFERMEDADES FIBROTICAS CRÓNICAS CON UN FENOTIPO PROGRESIVO
El ensayo INBUILD® fue un ensayo aleatorizado, doble ciego, controlado con placebo, de grupos paralelos realizado en 153 sitios en 15 países que evaluó la eficacia, seguridad y tolerabilidad de nintedanib (150 mg, 2 veces al día) durante 52 semanas en pacientes con enfermedad pulmonar intersticial fibrosante progresiva. Los pacientes elegibles tenían ≥ 18 años con una EPID diagnosticada por un médico diferente a la FPI y características de enfermedad pulmonar fibrosante de > 10% de extensión en la tomografía computarizada de alta resolución (TACAR). Se requirió que los pacientes cumplieran los criterios para la progresión de la EPID dentro de los 24 meses previos al cribado, en función de la disminución de la CVF, el aumento de los cambios fibróticos en las imágenes o el empeoramiento de los síntomas a pesar del tratamiento con fármacos comúnmente utilizados en la práctica clínica para tratar la EPID.
En el ensayo INBUILD, nintedanib redujo el declive de la función pulmonar en un 57% en la población total del estudio, con una tasa anual ajustada de declive durante 52 semanas en la FVC de -80,8 ml / año en comparación con -187,8 ml / año para placebo (diferencia, 107,0 ml / año [IC del 95%, 65,4 a 148,5]; p <0,001)
Los principales criterios de valoración secundarios fueron el cambio absoluto desde el valor inicial en la puntuación total del cuestionario de estado de salud de la enfermedad pulmonar intersticial breve de King (K-BILD) en la semana 52, el tiempo hasta la exacerbación aguda de la EPID o la muerte durante 52 semanas y el tiempo hasta la muerte durante 52 semanas. En la población general, el cambio desde el inicio en el estado de salud en la semana 52 en los grupos de nintedanib y placebo, respectivamente, fue de 0,55 y -0,79. La proporción de pacientes con exacerbación aguda de EPID o muerte durante 52 semanas fue del 7,8% en el grupo de nintedanib y del 9,7% en el grupo de placebo en la población general. La proporción de pacientes que murieron durante 52 semanas fue del 4,8% en el grupo de nintedanib y del 5,1% en el grupo de placebo. Una exacerbación aguda es un deterioro repentino y clínicamente significativo de la función respiratoria, en muchos casos de causa desconocida, que repercute negativamente en el curso de la enfermedad y a menudo conduce a la muerte.
El acontecimiento adverso más frecuente fue la diarrea, notificada en el 66,9% y el 23,9% de los pacientes tratados con nintedanib y placebo, respectivamente, con un perfil de seguridad consistente con lo que se había observado anteriormente con nintedanib. Las náuseas, los vómitos, el dolor abdominal, la disminución del apetito y la disminución de peso fueron más frecuentes en el grupo de nintedanib que en el grupo de placebo. El tratamiento con nintedanib se asoció con elevaciones de las enzimas hepáticas, que se normalizaron o mostraron una tendencia hacia la normalización al reducir la dosis, interrumpir o suspender el tratamiento, o de forma espontánea.
Datos del diseño del estudio
Criterios de exclusión
▪ FPI diagnosticada por un médico
▪ Obstrucción relevante de las vías respiratorias (es decir, FEV1 / FVC prebroncodilatador <0,7)
▪ Hipertensión pulmonar significativa
▪ Limite superior de lo normal de ALT, AST o bilirrubina 1.5x
▪ Riesgo conocido o predisposición a sangrar
▪ Pacientes que reciben una dosis completa de tratamiento anticoagulante.
▪ Historia reciente de infarto de miocardio o accidente cerebrovascular
▪ Los pacientes también fueron excluidos si recibieron otro tratamiento en investigación, azatioprina, ciclosporina, micofenolato de mofetilo, tacrolimus, corticosteroides orales> 20 mg / día, o la combinación de corticosteroides orales + azatioprina + n-acetilcisteína dentro de las 4 semanas posteriores a la aleatorización, ciclofosfamida dentro de las 8 semanas. antes de la aleatorización, o rituximab dentro de los 6 meses, o tratamiento previo con nintedanib o pirfenidona